- Gerar link
- X
- Outros aplicativos
EM TODAS AS ÁREAS DA FÍSICIA E EM SEUS FENÔMENOS EM ESCALA ÍNFIMA E INFINITA, E EM TERMOS DO INFINITO-DIMENSIONAL GRACELI, SE TEM UM UNIVERSO DE INDETERMINALIDADE E ALEATORIEDADE, NÃO VOU TRATAR COMO QUÂNTICO POR SE TRATAR NESTE CASO DE TEORIA DE ONDAS.
OU SEJA, SE TEM UM FERRO EM INCANDESCÊNCIA SE TEM NESTE CASO AS PARTÍCULAS DO FERRO COM VARIAÇÕES DE PROCESSOS E TRANSFORMAÇÕES ÍNFIMAS DENTRO DO SISTEMA DO INFINITO DIMENSIONAL GRACELI.
OU SEJA, SE ENCONTRA NUM UNIVERSO DE INDETERMINALIDADE E ALEATORIEDADE DINÃMICA E TRANSFORMATIVA.
COM PROCESSOS E INTENSIDADES ESPECÍFICOS PARA O FERRO.
OU SEJA, SE TEM
TEORIA GENERALIZADA GRACELI DA ABSORÇÃO, EMISSSÃO, TRANSIÇÃO, TRANSFERÊNCIA DE ENERGIA E MOMENTUN, TUNELAMENTO, DIFUSÃO, REFRAÇÃO, RETRAÇÃO, FUSÕES, DILATAÇÃO, E OUTROS.
E PONTOS CRÍTICOS DE FUSÕES, EBULIÇÕES, MUDANÇAS DE FASES, ENTROPIAS, ENTALPIAS, ETC.
ACELERAÇÕES DE FENÔMENOS TERMICOS, RADIAÇÕES, E DILATAÇÕES., ETC.
ISTO PARA TODOS OS FENÔMENSO DENTRO DAS FÍSICAS E QUÍMICAS.
SENDO QUE CADA UM DESTES FENÔMENOS CONTÉM RELAÇÕES ENTRE SI E CONFORME OS TIPOS DE MATERIAIS E MESMO NUM MESMO TIPO DE MATERIAL VARIA DE UNS PARA OUTROS, .
EXEMPLO.
COMO DE FERRO PARA ALUMÍNIO, E DE ALGUNS ALUMÍNIOS PARA OUTROS ALUMÍNIOS,
O MESMO PARA TODOS OS TIPOS DE MATERIAIS E ELEMENTOS QUÍMICO, MOLÍCULAS E PARTÍCULAS.
E CONORME O SISTEMA DO INFINITO-DIMENSIONAL GRACELI.
OU SEJA, UM RELATIVISMO QUÍMICO E FÍSICO QUÍMICO.
RELATIVIDADE DIMENSIONAL GRACELI.
TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL.
TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL.
ONDE CADA INFINITA PARTÍCULA TEM INFINITAS DIMENSÕES FORMANDO UM SISTEMA GERAL UNIFICATÓRIO COM PADRÕES DE VARIAÇÕES CONFORME AS PARTÍCULA QUE NO CASO PASSAM A REPRESENTAR DIMENSÕES, PADRÕES DE ENERGIAS E E PADRÕES POTENCIAIS DE TRANSFORMAÇÕES, INTERAÇÕES CATEGORIAS FÍSICAS DE GRACELI E OUTROS.
NA TEORIA DAS CORDAS PARTÍCULAS SÃO REPRESNTADAS POR VIBRAÇÕES.
JÁ NA TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL. NO CASO SÃO REPRENTADOS POR DIMENSÕES FÍSICAS E QUÍMICA DE GRACELI.
TEORIA FÍSICA DE GRACELI GENERALIZADA ENTRE SDCTIE , TENSORES DE GRACELI, NO :
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
sistema indeterminístico Graceli ;
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químico
SISTEMA GRACELI INFINITO-DIMENSIONAL.
SISTEMA GRACELI INFINITO-DIMENSIONAL.
COM ELEMENTOS DO SISTEMA SDCTIE GRACELI, TENSOR G+ GRACELI CAMPOS E ENERGIA, E ENERGIA, E CONFIGURAÇÕES ELETRÔNICAS DOS ELEMENTOS QUÍMICO, E OUTRAS ESTRUTURAS.
ESTADO E NÚMERO QUÂNTICO, NÍVEIS DE ENERGIA DO ÁTOMO, FREQUÊNCIA. E OUTROS.
TENSOR G+ GRACELI, SDCTIE GRACELI, DENSIDADE DE CARGA E DISTRIBUIÇÃO ELETRÔNICA, NÍVEIS DE ENERGIA, NÚMERO E ESTADO QUÂNTICO. + POTENCIAL DE SALTO QUÂNTICO RELATIVO AOS ELEMENTOS QUÍMICO COM O SEU RESPECTIVO E ESPECÍFICO NÍVEL DE ENERGIA.
SISTEMA MULTIDIMENSIONAL GRACELI
ONDE A CONFIGURAÇÃO ELETRÔNICA TAMBÉM PASSA A SER DIMENSÕES FÍSICO-QUÍMICA DE GRACELI.
Configuração eletrônica dos elementos químicos. [parte do sistema Graceli infinito-dimensional].
Calor específico é uma grandeza física intensiva que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. A unidade no SI é J/(kg.K) (joule por quilograma e por kelvin). Uma unidade usual bastante utilizada para calores específicos é cal/(g °C) (caloria por grama e por grau Celsius).[1]
Em rigor há dois calores específicos distintos: o calor específico a volume constante 


Materiais com dilatação anômala, como a água entre 0 °C e 4 °C, não obedecem à regra anterior; nestes casos o calor específico a volume constante é então um pouco maior do que o calor específico a pressão constante.
Definição
O calor específico (


////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
A capacidade térmica, por sua vez, é definida como a razão entre calor recebido e variação de temperatura observada. Assim, o calor específico pode ser expresso como:
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Por essa última relação, nota-se que o calor específico depende do processo pelo qual o calor é cedido à substância. Usando a primeira lei da termodinâmica, com 
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Dois casos particulares são de maior importância. Um deles é o calor específico a volume constante, onde o termo representando o trabalho (
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
O segundo caso é o calor específico a pressão constante. Nesse caso, a equação anterior resulta em

////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
onde a nova função de estado 
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
A distinção entre esses dois calores específicos pode normalmente ser ignorada nas fases sólida e líquida, dado que essas substâncias normalmente sofrem uma variação de volume muito pequena. Gases, no entanto, apresentam grande expansão térmica, sendo sempre necessária a distinção entre ambos os calores específicos.
Calor específico molar
Em muitas circunstâncias a unidade mais conveniente para especificar a quantidade de uma substancia é o mol, definido como sendo uma quantidade de 6,02 x 1023 unidades elementares de qualquer substância. Assim, por exemplo um mol de alumínio significa 6,02 x 1023 átomos de alumínio (o átomo é a unidade elementar), e 1 mol de óxido de alumínio significa 6,02 x 1023 fórmulas moleculares do composto.
Nesses casos, quando a quantidade de substância é expressa em moles, utiliza-se o chamado calor específico molar, que é expresso como sendo a capacidade térmica por mol.[4] De forma análoga com o calor específico por massa, o calor específico molar depende do processo ao qual a substância é submetida; define-se de mesma forma as quantidades a pressão constante e a volume constante.
Calor específico molar a volume constante
O calor específico molar a volume constante é definido como:
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Sendo que,

////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
(primeira lei da termodinâmica) com o trabalho 

onde:
é o calor absorvido ou cedido por uma amostra de
moles de um gás;
é a variação de temperatura resultante;
é a variação de energia interna.
Para um gás monoatômico ideal,
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Calor específico molar a pressão constante
O calor específico molar a pressão constante é definido como:
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Sendo que temos as seguintes relações:




////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Substituindo a as respectivas equações mais a equação 
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
na equação 
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
icamos com
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
onde:
é o calor absorvido ou cedido por uma amostra de
mols de um gás;
é a variação de temperatura resultante;
é a variação de energia interna.
Regra de Dulong-Petit
A regra de Dulong-Petit consiste em obter, aproximadamente, o calor específico das substâncias por meio da massa molar:
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Em que:
é o calor específico, em joule por quilograma kelvin (J.kg−1.K−1);
é a constante dos gases reais, equivalente a 8,31 joules por mol kelvin (J.K−1.mol−1);
é a massa molar, em quilograma por mol (kg/mol).
Unidades
Sistema internacional
A unidade SI para calor específico é joule por kelvin por quilograma (J / K / kg, J / (kg K), JK -1 kg -1 , etc.). Como um incremento de temperatura de um grau Celsius é o mesmo que um incremento de um kelvin, é o mesmo que joule por grau Celsius por quilograma (J / ° C / kg). Às vezes, o grama é usado em vez de quilograma para a unidade de massa: 1 J / K / kg = 0,001 J / K / g.
O calor específico de uma substância (por unidade de massa) tem dimensão L 2 · T − 2 · Θ −1 ou (L / T) 2 / Θ. Portanto, a unidade SI J / K / kg é equivalente ao metro quadrado por segundo ao quadrado por kelvin (m 2 K −1 s −2 ).
Unidades de engenharia inglesas (imperiais)
Profissionais da construção , engenharia civil , engenharia química e outras disciplinas técnicas, especialmente no Estados Unidos , pode utilizar os chamados unidades de Inglês Engenharia , que incluem a imperial libra (lb = 0,45459237 kg) como unidade de massa, o grau Fahrenheit ou Rankine (° F = 5/9 K, cerca de 0,555556 K) como a unidade de incremento de temperatura, e a unidade térmica britânica (BTU ≈ 1055.06 J), [5] [6] como a unidade de calor.
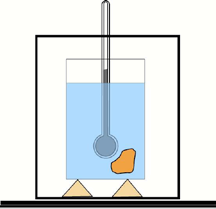
Medição do calor específico de uma substância
A capacidade calorífica de um corpo é determinada com ajuda de um calorímetro e um termômetro. Um calorímetro simples (veja a figura) consiste num cilindro metálico polido, colocado num outro cilindro metálico sobre cortiça (para isolamento térmico).[7]
O calor específico de uma substância é normalmente determinado de acordo com a definição; ou seja, medindo a capacidade térmica de uma amostra da substância, geralmente com um calorímetro , e dividindo pela massa da amostra. Várias técnicas podem ser aplicadas para estimar a capacidade térmica de uma substância como, por exemplo, calorimetria de varredura diferencial rápida . [8] [9]
O cilindro interno é enchido com água ou algum outro líquido de calor específico conhecido. Um corpo de massa m, e capacidade calorífica específica c, aquecido a uma certa temperatura T é imergido no calorímetro de massa m1 e capacidade calorífica c1 na qual a temperatura é medida. Suponha que a temperatura deste líquido de m2 e capacidade calorífica específica c2 no calorímetro é T’ antes de o corpo ser emergido nele, e quando a temperatura do líquido e do corpo é a mesma, a temperatura torna-se Tf.
Da lei de conservação da energia e considerando o calor dissipado na vizinhança pelo objecto quente Q, o calor recebido pela água e pelo calorímetro que seja respectivamente Q1 e Q2 , mostra que a capacidade calorífica específica é
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
Fatores que afetam o calor específico
Moléculas sofrem muitas vibrações características internas. A energia potencial armazenada nestes graus de liberdade internos contribui para uma amostra do conteúdo de energia, mas não a sua temperatura. Graus de liberdade mais internos tendem a aumentar a capacidade de uma substância de calor específico, contanto que as temperaturas são suficientemente elevadas para superar os efeitos quânticos.
Graus de liberdade
O comportamento termodinâmico das moléculas dos gases monoatômicos, como hélio, e dos gases diatômicos, como o nitrogênio, é muito diferente. Em gases monoatômicos, a energia interna é unicamente para movimentos de translação. Os movimentos são movimentos de translação em um espaço tridimensional em que as partículas se movem e trocam energia em colisões elásticas da mesma forma como fariam bolas de borracha colocadas num recipiente que foi agitado fortemente. (Veja animação aqui). Estes movimentos nas dimensões X, Y, e Z significam que os gases monoatômicos tem apenas três graus de liberdade de translação. Moléculas com maior atomicidade, no entanto, tem vários graus de liberdade interna, rotacionais e vibracionais. Elas se comportam como uma população de átomos que podem se mover dentro de uma molécula de formas diferentes (veja a animação à direita). A energia interna é armazenada nesses movimentos internos. Por exemplo, o nitrogênio, que é uma molécula diatômica, tem cinco graus de liberdade: três de translação e dois de rotação interna. Note que a calor específico molar a volume constante do gás monoatômico é 


////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
onde 
Massa molar
Uma razão pela qual o calor específico tem valores diferentes para diferentes substâncias é a diferença de massas molares, que é a massa de um mol de qualquer elemento, que é diretamente proporcional à massa molecular do elemento, a soma dos valores das massas atômicas da molécula em questão. A energia térmica é armazenada pela existência de átomos ou moléculas de vibração. Se uma substância tem uma massa molar mais leve, em seguida, cada grama de que tem mais átomos ou moléculas disponíveis para armazenar energia. Esta é a razão pela qual o hidrogênio, a substância com menor massa molar tem um calor específico muito elevado. A consequência deste fenômeno é a de que, quando se mede o calor específico em termos molares a diferença entre substâncias torna-se menos acentuada e o calor específico de hidrogênio para de ser atípico. Da mesma forma, as substâncias moleculares (também absorvem calor em seus graus de liberdade internos) pode armazenar grandes quantidades de energia por mol se é moléculas grandes e complexas, e, portanto, seu calor específico medido em massa é menos perceptível . Uma vez que a densidade média de um elemento químico está fortemente relacionada com a sua massa molar, em termos gerais, há uma forte correlação inversa entre a densidade do sólido e o 
As ligações de hidrogênio
Contendo hidrogênio na sua composição, moléculas polares como o etanol, amônia e água, têm poderosas ligações intermoleculares de hidrogênio quando em sua fase líquida. Estas ligações proporcionam um outro local em que o calor pode ser armazenado como energia potencial de vibração, mesmo em baixas temperaturas comparativamente.
Impurezas
No caso de ligas, existem certas condições em que as pequenas impurezas podem alterar grandemente o calor específico medido. As ligas podem mostrar uma diferença marcada no seu comportamento, mesmo que a impureza em questão seja um dos elementos que formam a liga, tais como ligas impuras em semicondutores ferromagnéticos que podem conduzir a medições muito diferentes.
A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.
| Substância | Calor Específico (cal/g.°C) |
|---|---|
| água | 1,0 |
| álcool | 0,58 |
| alumínio | 0,22 |
| ar | 0,24 |
| carbono | 0,12 |
| chumbo | 0,031 |
| cobre | 0,094 |
| ferro | 0,11 |
| gelo | 0,5 |
| hélio | 1,25 |
| hidrogênio | 3,4 |
| latão | 0,092 |
| madeira | 0,42 |
| mercúrio | 0,033 |
| nitrogênio | 0,25 |
| ouro | 0,032 |
| oxigênio | 0,22 |
| prata | 0,056 |
| rochas | 0,21 |
| vidro | 0,16 |
| zinco | 0,093 |
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
O ponto de fusão designa a temperatura à qual uma substância passa do estado sólido ao estado líquido. Eis abaixo uma breve lista dos elementos químicos e seus respectivos pontos de fusão.
Elementos químicos em ordem crescente do ponto de fusão
| Elemento | Símbolo | Número atômico (Z) | Ponto de fusão (K) | Ponto de fusão (°C) |
| Hélio | He | 2 | 0,95 | -272,2 |
| Hidrogênio | H | 1 | 13,81 | -259,34 |
| Neônio | Ne | 10 | 24,56 | -248,59 |
| Flúor | F | 9 | 53,53 | -219,52 |
| Oxigênio | O | 8 | 54,85 | -218,3 |
| Nitrogênio | N | 7 | 63,25 | -209,9 |
| Argônio | Ar | 18 | 83,8 | -189,35 |
| Criptônio | Kr | 36 | 115,77 | -157,38 |
| Xenônio | Xe | 54 | 161,36 | -117,79 |
| Cloro | Cl | 17 | 171,65 | -101,5 |
| Radônio | Rn | 86 | 202,15 | -71,8 |
| Fleróvio | Fl | 114 | 210 (estimado) | -63,15 |
| Mercúrio | Hg | 80 | 234,32 | -38,83 |
| Bromo | Br | 35 | 265,95 | -7,2 |
| Frâncio | Fr | 87 | 300,15 | 27 |
| Césio | Cs | 55 | 301,65 | 28,5 |
| Gálio | Ga | 31 | 302,91 | 29,76 |
| Rubídio | Rb | 37 | 312,46 | 39,31 |
| Fósforo | P | 15 | 317,35 | 44,2 |
| Oganésson | Og | 118 | 320 (estimado) | 46,85 |
| Potássio | K | 19 | 336,65 | 63,5 |
| Sódio | Na | 11 | 370,95 | 97,8 |
| Iodo | I | 53 | 386,85 | 113,7 |
| Enxofre | S | 16 | 392,75 | 115,21 |
| Índio | In | 49 | 429,75 | 156,6 |
| Lítio | Li | 3 | 453,65 | 180,5 |
| Selênio | Se | 34 | 493,65 | 220,5 |
| Estanho | Sn | 50 | 505,08 | 231,93 |
| Polônio | Po | 84 | 527,15 | 254 |
| Bismuto | Bi | 83 | 544,45 | 271,3 |
| Astato | At | 85 | 575,15 | 302 |
| Tálio | Tl | 81 | 577,15 | 304 |
| Cádmio | Cd | 48 | 594,22 | 321,07 |
| Chumbo | Pb | 82 | 600,61 | 327,46 |
| Moscóvio | Mc | 115 | 670 (estimado) | 396,85 |
| Zinco | Zn | 30 | 692,73 | 419,58 |
| Nipônio | Nh | 113 | 700 (estimado) | 426,85 |
| Telúrio | Te | 52 | 722,66 | 449,51 |
| Antimônio | Sb | 51 | 903,78 | 630,63 |
| Netúnio | Np | 93 | 910,15 | 637 |
| Plutônio | Pu | 94 | 912,55 | 639,4 |
| Magnésio | Mg | 12 | 923,15 | 650 |
| Alumínio | Al | 13 | 933,15 | 660 |
| Rádio | Ra | 88 | 973,15 | 700 |
| Bário | Ba | 56 | 1 000,15 | 727 |
| Estrôncio | Sr | 38 | 1 050,15 | 777 |
| Cério | Ce | 58 | 1 071,15 | 798 |
| Arsênio | As | 33 | 1 090,15 | 817 |
| Európio | Eu | 63 | 1 095,15 | 822 |
| Itérbio | Yb | 70 | 1 097,15 | 824 |
| Mendelévio | Md | 101 | 1 100,15 | 827 |
| Nobélio | No | 102 | 1 100,15 | 827 |
| Cálcio | Ca | 20 | 1 115,15 | 842 |
| Einstênio | Es | 99 | 1 133,15 | 860 |
| Califórnio | Cf | 98 | 1 173,15 | 900 |
| Lantânio | La | 57 | 1 193,15 | 920 |
| Praseodímio | Pr | 59 | 1 203,95 | 930,8 |
| Germânio | Ge | 32 | 1 211,45 | 938,3 |
| Prata | Ag | 47 | 1 234,93 | 961,78 |
| Berquélio | Bk | 97 | 1 259,15 | 986 |
| Neodímio | Nd | 60 | 1 294,15 | 1 021 |
| Actínio | Ac | 89 | 1 323,15 | 1 050 |
| Ouro | Au | 79 | 1 337,33 | 1 064,18 |
| Cobre | Cu | 29 | 1 357,77 | 1 084,62 |
| Promécio | Pm | 61 | 1 373,15 | 1 100 |
| Urânio | U | 92 | 1405,35 | 1 132,2 |
| Amerício | Am | 95 | 1 449,15 | 1 176 |
| Manganês | Mn | 25 | 1 519,15 | 1 246 |
| Berílio | Be | 4 | 1 560,15 | 1 287 |
| Gadolínio | Gd | 64 | 1 586,15 | 1 313 |
| Cúrio | Cm | 96 | 1 613,15 | 1 340 |
| Térbio | Tb | 65 | 1 629,15 | 1 356 |
| Disprósio | Dy | 66 | 1 685,15 | 1 412 |
| Silício | Si | 14 | 1 687,15 | 1 414 |
| Níquel | Ni | 28 | 1 728,15 | 1 455 |
| Hólmio | Ho | 67 | 1 743,15 | 1 470 |
| Cobalto | Co | 27 | 1 768,15 | 1 495 |
| Ítrio | Y | 39 | 1 795,15 | 1 522 |
| Férmio | Fm | 100 | 1 800,15 | 1 527 |
| Érbio | Er | 68 | 1 802,15 | 1529 |
| Ferro | Fe | 26 | 1 811,15 | 1 538 |
| Escândio | Sc | 21 | 1 814,15 | 1 541 |
| Túlio | Tm | 69 | 1 818,15 | 1 545 |
| Paládio | Pd | 46 | 1 827,15 | 1 554 |
| Protactínio | Pa | 91 | 1 845,15 | 1 572 |
| Laurêncio | Lr | 103 | 1 900,15 | 1 627 |
| Lutécio | Lu | 71 | 1 936,15 | 1 663 |
| Titânio | Ti | 22 | 1 941,15 | 1 668 |
| Samário | Sm | 62 | 1 977,15 | 1 704 |
| Tório | Th | 90 | 2 023,15 | 1 750 |
| Platina | Pt | 78 | 2 041,55 | 1 768,4 |
| Zircônio | Zr | 40 | 2 128,15 | 1 855 |
| Crômio | Cr | 24 | 2 180,15 | 1 907 |
| Vanádio | V | 23 | 2 183,15 | 1 910 |
| Ródio | Rh | 45 | 2 237,15 | 1 964 |
| Boro | B | 5 | 2 348,15 | 2 075 |
| Rutherfórdio | Rf | 104 | 2 400 (estimado) | 2 126,85 |
| Tecnécio | Tc | 43 | 2 430,15 | 2 157 |
| Háfnio | Hf | 72 | 2 506,15 | 2 233 |
| Rutênio | Ru | 44 | 2 607,15 | 2 334 |
| Irídio | Ir | 77 | 2 719,15 | 2 446 |
| Nióbio | Nb | 41 | 2 750,15 | 2 477 |
| Molibdênio | Mo | 42 | 2 896,15 | 2 623 |
| Tântalo | Ta | 73 | 3 290,15 | 3 017 |
| Ósmio | Os | 76 | 3 306,15 | 3 033 |
| Rênio | Re | 75 | 3 459,15 | 3 186 |
| Tungstênio | W | 74 | 3 695,15 | 3 414 |
| Carbono | C | 6 | 3 800,15 | 3 527 |
| Bóhrio | Bh | 107 | – | – |
| Copernício | Cn | 112 | – | – |
| Darmstádtio | Ds | 110 | – | – |
| Dúbnio | Db | 105 | – | – |
| Hássio | Hs | 108 | – | – |
| Livermório | Lv | 116 | – | – |
| Meitnério | Mt | 109 | – | – |
| Roentgênio | Rg | 111 | – | – |
| Seabórgio | Sg | 106 | – | – |
| Tenesso | Ts | 117 | – | – |
////
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
- Gerar link
- X
- Outros aplicativos











Comentários
Postar um comentário